
ΠΑΠΑΔΟΠΟΥΛΟΥ ΕΛΕΥΘΕΡΙΑ MD, PhD Ιατρός Γενετίστρια, τ. Διευθύντρια ΕΣΥ Παιδιατρικής Κλινικής ΠαΓΝΗ
Το Whole Exome Sequencing (WES) αποτελεί βασικό εργαλείο της σύγχρονης Παιδιατρικής. Η εφαρμογή του προσφέρει υψηλή διαγνωστική απόδοση και μειώνει σημαντικά τον χρόνο διάγνωσης των γενετικών νόσων στα παιδιά.
Περίληψη
Η πρόοδος της Μοριακής Γενετικής έχει καταστήσει το Whole Exome Sequencing (WES) ένα από τα σημαντικότερα διαγνωστικά εργαλεία στην Παιδιατρική, καθώς επιτρέπει την ταυτόχρονη ανάλυση όλων των εξωνίων του γονιδιώματος, όπου εντοπίζεται περίπου το 85% των παθογόνων μεταλλάξεων, υπεύθυνων για τα μονογονιδιακά νοσήματα του ανθρώπου. Το WES παρουσιάζει υψηλή διαγνωστική απόδοση σε παιδιά με νευροαναπτυξιακές διαταραχές, πρώιμης έναρξης ή ανθεκτική επιληψία, συγγενείς δυσμορφίες, μεταβολικά και μιτοχονδριακά νοσήματα, πρωτοπαθείς ανοσοανεπάρκειες και σοβαρά, αδιευκρίνιστα νεογνικά ή παιδιατρικά περιστατικά, μειώνοντας δραστικά τον χρόνο διάγνωσης
σε σύγκριση με την κλασική διαγνωστική προσέγγιση. Η χρήση trio-WES και ταχέος WES σε μονάδες εντατικής θεραπείας ενισχύει περαιτέρω την κλινική του αξία, οδηγώντας σε αλλαγές στη θεραπευτική στρατηγική και στη βελτίωση της πρόγνωσης, ενώ παράλληλα αναδεικνύονται τεχνικοί, ερμηνευτικοί και βιοηθικοί περιορισμοί που καθιστούν απαραίτητη τη διεπιστημονική συνεργασία και την εξειδικευμένη γενετική συμβουλευτική.
ΕΙΣΑΓΩΓΗ: Η ΘΕΣΗ ΤΟΥ WES ΣΤΗ ΣΥΓΧΡΟΝΗ ΠΑΙΔΙΑΤΡΙΚΗ
Η ραγδαία εξέλιξη της Γενετικής και της Μοριακής Διαγνωστικής έχει αναβαθμίσει σημαντικά την Παιδιατρική Ιατρική την τελευταία δεκαετία. Μεταξύ των σημαντικότερων εξελίξεων συγκαταλέγεται η εφαρμογή της τεχνολογίας Whole Exome Sequencing (WES), η οποία επιτρέπει την ανάλυση όλων των εξωνίων του ανθρώπινου γονιδιώματος. Καθώς περίπου το 85% των παθογονικών μεταλλάξεων εντοπίζονται σε κωδικοποιητικές περιοχές, το WES αποτελεί ένα ισχυρό εργαλείο για τη διάγνωση γενετικών νοσημάτων στην παιδική ηλικία, μια περίοδο όπου η έγκαιρη διάγνωση μπορεί να αλλάξει ριζικά την έκβαση της νόσου του παιδιού.
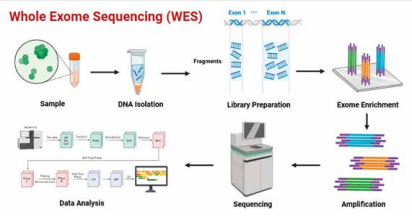
Η επίπτωση των γενετικών νοσημάτων παραμένει σταθερή, παρά την εξέλιξη στο πεδίο της Γενετικής. Υπολογίζεται ότι περίπου 53 στα 1000 άτομα θα εμφανίσουν κάποια
μονογονιδιακή, χρωμοσωμική ή πολυπαραγοντική νόσο μέχρι την ηλικία των 25 ετών. Τα σπάνια γενετικά νοσήματα δεν είναι τόσο “σπάνια” στην Παιδιατρική: εκτιμάται ότι 1
στα 25 παιδιά πάσχει από κάποια γενετική διαταραχή. Επιπλέον, οι γενετικοί παράγοντες συμβάλλουν σημαντικά σε πληθώρα παιδιατρικών καταστάσεων, από συγγενείς
δυσμορφίες και νευροαναπτυξιακές διαταραχές έως μεταβολικά νοσήματα, καρδιοπάθειες και ανοσοανεπάρκειες. Ωστόσο, η κλινική εικόνα συχνά είναι μη ειδική, με αποτέλεσμα η διάγνωση να καθυστερεί για μήνες ή και χρόνια. Εδώ αναδεικνύεται η αξία του WES, το οποίο προσφέρει:
• Υψηλή διαγνωστική απόδοση, συχνά 25–50% ανάλογα με το φαινότυπο.
• Δυνατότητα ταυτόχρονης ανάλυσης χιλιάδων γονιδίων, χωρίς την ανάγκη διαδοχικών εξετάσεων.
• Αποτελεσματικότητα κόστους, καθώς συχνά υποκαθιστά μία μακρά και δαπανηρή σειρά άλλων εξετάσεων. • Εφαρμογή σε οξείες και χρόνιες παιδιατρικές καταστάσεις.
Η διερεύνηση ακολουθεί πλέον μια προσέγγιση που ξεκινά από το γονίδιο (“genefirst”) και οδηγεί σε μια ακριβή διάγνωση βάσει του φαινότυπου (“phenotype-guided precision diagnosis”). Με απλά λόγια, αντί να προσπαθούμε πρώτα να «μαντέψουμε» τη διάγνωση μόνο από τα συμπτώματα και μετά να ζητήσουμε στοχευμένες εξετάσεις, εξετάζουμε μεγάλο αριθμό γονιδίων εξαρχής (π.χ. με WES). Έτσι εντοπίζουμε πιθανές παθολογικές μεταλλάξεις και στη συνέχεια ερμηνεύουμε τα ευρήματα σε σχέση με την κλινική εικόνα του
παιδιού. Τι κερδίζουμε με αυτή την προσέγγιση:
• πιο γρήγορος και ακριβής προσδιορισμός της διάγνωσης
• καλύτερος προγραμματισμός θεραπείας ή παρακολούθησης
• στοχευμένη και τεκμηριωμένη γενετική συμβουλευτική προς την οικογένεια
• αποφυγή άσκοπων εξετάσεων, βιοψιών ή επαναλαμβανόμενων ελέγχων Το WES ενδείκνυται ιδιαίτερα όταν:
• Υπάρχει πολυπαραγοντική ή ασαφής κλινική εικόνα.
• Υποψιαζόμαστε σπάνιο, γονιδιακά ετερογενές νόσημα.
• Υπάρχει πιθανότητα de novo (νέων) μεταλλάξεων (συχνές στα παιδιά).
• Έχουν προηγηθεί αρνητικά στοχευμένα γενετικά τεστ.
Οι διεθνείς οδηγίες από American College of Medical Genetics and Genomics (ACMG) και American Academy of Pediatrics (AAP) συστήνουν πλέον την πρώιμη χρήση του WES σε δύσκολα διαγνωστικά περιστατικά, αναγνωρίζοντας την υψηλή του κλινική αξία.
ΚΛΙΝΙΚΕΣ ΕΝΔΕΙΞΕΙΣ ΚΑΙ ΔΙΑΓΝΩΣΤΙΚΗ ΑΞΙΑ ΤΟΥ WES
Το WES έχει ευρεία εφαρμογή στην Παιδιατρική και αποτελεί σήμερα βασικό εργαλείο σε πολλούς τομείς της κλινικής πρακτικής. Οι υψηλότερες αποδόσεις καταγράφονται στις
ακόλουθες ομάδες νοσημάτων:

- Νευροαναπτυξιακές διαταραχές (NDDs) Αυτές περιλαμβάνουν νοητική καθυστέρηση, αυτισμό, επιληψία, υποτονία και διαταραχές συμπεριφοράς. Μελέτες δείχνουν διαγνωστική απόδοση 30–60%. Τα αποτελέσματα συχνά οδηγούν σε αλλαγή θεραπευτικής προσέγγισης, όπως στοχευμένη αντιεπιληπτική αγωγή ή παραπομπή για γονιδιακές θεραπείες.
- Συγγενείς δυσμορφίες και σύνδρομα πολλαπλών ανωμαλιών
Το WES επιτρέπει την αναγνώριση νέων ή άτυπων συνδρόμων, διευκολύνοντας την κλινική διαχείριση και την πρόγνωση. - Μεταβολικά νοσήματα Η έγκαιρη διάγνωση μπορεί να είναι κυριολεκτικά σωτήρια. Το WES συμβάλλει σε καταστάσεις όπου οι βιοχημικές εξετάσεις δεν είναι διαγνωστικές.
- Συγγενείς καρδιοπάθειες Η χρήση WES μπορεί να εντοπίσει παθογόνες μεταλλάξεις σε παιδιά με υποψία μονογονιδιακής αιτιολογίας, ειδικά όταν υπάρχουν επιπλέον εξωκαρδιακές ανωμαλίες.
- Πρωτοπαθείς ανοσοανεπάρκειες Η ταχεία έναρξη ανοσορυθμιστικής αγωγής ή η λήψη αποφάσεων για μεταμόσχευση εξαρτάται συχνά από τη γενετική επιβεβαίωση.
- Νεογνική και Παιδιατρική ΜΕΘ Το WES, ιδίως το ταχύ WES (rWES), μπορεί να οδηγήσει σε διάγνωση εντός 5–10 ημερών, επηρεάζοντας άμεσα την κλινική έκβαση και την επιβίωση.

Διαγνωστική απόδοση (Diagnostic Yield)
Με βάση διεθνείς μετα-αναλύσεις: • Συνολική απόδοση WES: 30–40%
• Τριπλέτα γονιδίων (Trio-WES): 40–55%
• Ταχύ WES στη ΜΕΘ: έως 60%
Η χρήση Trio-WES (παιδί + γονείς) αυξάνει σημαντικά την ακρίβεια ερμηνείας των ευρημάτων, περιορίζοντας τα VUS (variants of uncertain significance).

Συγκριτικά πλεονεκτήματα έναντι άλλων τεχνικών
• Καλύτερη απόδοση από targeted panels στις ετερογενείς συνθήκες.
• Καλύτερη κάλυψη των εξωνίων από το Whole Genome Sequencing (αν και το WGS προσφέρει ευρύτερη ανάλυση, το WES παραμένει πιο προσιτό και διαθέσιμο).
• Αποτελεσματικότερο από τη χρωμοσωμική ανάλυση σε μονογονιδιακές διαταραχές.
ΠΕΡΙΟΡΙΣΜΟΙ, ΠΡΟΚΛΗΣΕΙΣ ΚΑΙ ΒΙΟΗΘΙΚΑ ΖΗΤΗΜΑΤΑ
Παρά τα πολλαπλά πλεονεκτήματα, το WES έχει σημαντικούς περιορισμούς που πρέπει να λαμβάνονται υπόψη στην κλινική πράξη.
- Τεχνικοί περιορισμοί
• Μη ανίχνευση μεγάλων αναδιατάξεων, μεθυλίωσης, επανειλημμένων επεκτάσεων (repeat expansions). • Περιοχές δύσκολες στην κάλυψη (GCrich,pseudogenes). • Περιορισμένη ανίχνευση CNVs σε σχέση με array-CGH, αν και υπάρχει βελτίωση με τις σύγχρονες πλατφόρμες. • Δυσκολία στην ανάλυση ρυθμιστικών περιοχών (μη κωδικοποιητικές). - Ερμηνεία αποτελεσμάτων Η ερμηνεία των παραλλαγών (variants) είναι ίσως το πλέον κρίσιμο στάδιο. Τα VUS αποτελούν συχνό εύρημα και μπορεί να προκαλέσουν σύγχυση στην οικογένεια και στους θεράποντες ιατρούς. Η ταξινόμηση κατά ACMG/AMP απαιτεί εξειδίκευση και συνεχή ενημέρωση.
- Ευρήματα δευτερεύουσας σημασίας (secondary findings) Το WES ενδέχεται να αποκαλύψει πληροφορίες άσχετες με το αίτημα εξέτασης αλλά σημαντικές για την υγεία του παιδιού ή των γονέων (π.χ. BRCA1, καρδιομυοπάθειες). Στην Ελλάδα και διεθνώς, η προγενέστερη συναίνεση (informed consent) πρέπει να καθορίζει: • αν θα αναζητηθούν αυτά τα ευρήματα • αν θα δοθούν στους γονείς • πώς θα γνωστοποιούνται στο παιδί όταν ενηλικιωθεί.
- Βιοηθικά ζητήματα • Δικαίωμα του παιδιού στο “να μην γνωρίζει”. • Πληροφόρηση για μη αναστρέψιμα νοσήματα χωρίς θεραπεία. • Επιπτώσεις στην αναπαραγωγική συμβουλευτική των γονέων. • Ψυχολογική επιβάρυνση της οικογένειας.
- Ζητήματα κόστους και πρόσβασης Παρά τη μείωση του κόστους, το WES παραμένει σχετικά δαπανηρό για πολλά συστήματα υγείας. Υπάρχει ανισότητα στην πρόσβαση ανάλογα με το κέντρο, τη χώρα και την ασφαλιστική κάλυψη.

ΚΛΙΝΙΚΗ ΕΝΣΩΜΑΤΩΣΗ, ΜΕΛΛΟΝΤΙΚΕΣ ΕΦΑΡΜΟΓΕΣ ΚΑΙ ΣΥΜΠΕΡΑΣΜΑΤΑ
- Πώς ενσωματώνεται το WES στην Παιδιατρική πρακτική Η επιτυχής χρήση του WES απαιτεί διεπιστημονική προσέγγιση: • Παιδίατρος – Κλινικός Γενετιστής • Βιοπληροφορικός • Εξειδικευμένα εργαστήρια • Ομάδα υποστήριξης οικογένειας
Η διαδικασία περιλαμβάνει:
- Λεπτομερές κλινικό ιστορικό και φαινότυπο
- Επιλογή κατάλληλου τύπου WES (solo,duo, trio).
- Ανάλυση και διασταύρωση ευρημάτων με φαινότυπο.
- Επιστροφή αποτελεσμάτων με συμβουλευτική.
- Επαναστοχοποίηση μετά από νέα δεδομένα (reanalysis) – με όφελος 10–15%.
- Μελλοντικές προοπτικές
• WGS (Whole Genome Sequencing): Θα αποτελέσει την επόμενη γενιά διαγνωστικής, αλλά ακόμη έχει υψηλότερο κόστος.
• Γονιδιακές και RNA-based θεραπείες: Η μοριακή διάγνωση αποτελεί κρίσιμο βήμα για εξατομικευμένες θεραπείες.
• AI & machine learning: Βελτιώνουν συνεχώς την ερμηνεία των παραλλαγών και τη φαινοτυπική αντιστοίχιση.
• Νεογνικός γενετικός έλεγχος: Πιθανότητα ενσωμάτωσης WES/WGS σε προγράμματα newborn screening για σοβαρά, θεραπεύσιμα νοσήματα.
• Φαρμακογονιδιωματική: Εξατομίκευση φαρμακευτικής αγωγής σε παιδιατρικούς ασθενείς.
Ε. ΒΙΒΛΙΟΓΡΑΦΙΚΕΣ ΠΑΡΑΠΟΜΠΕΣ
ACMG Board of Directors. Clinical utility of genetic and genomic services: a position statement of the American College of Medical Genetics and Genomics. Genet Med
2015;17(6):505–507.
Manickam et al. Exome and genome sequencing for pediatric patients with congenital anomalies or intellectual disability: an evidence-based clinical guideline of the ACMG. Genet Med 2021;23(11):2029–2037.
Miller et al, Recommendations for reporting of secondary findings in clinical exome and genome sequencing, 2021 update: a policy statement of the American College of Medical Genetics and Genomics (ACMG). Genet Med 2021;23(8):1391-1398
Rehm et al. ClinGen–the Clinical Genome Resource. N Engl J Med 2015;372(23):2235-2242.
Saunders et al. Rapid whole-genome sequencing for genetic disease diagnosis in neonatal intensive care units. Sci Transl Med 2012;4(154):154ra135.
Srivastava et al. Clinical whole exome sequencing in child neurology practice.
Ann Neurol 2014;76(4):473–483.
Stark et al. A prospective evaluation of whole-exome sequencing as a first-tier molecular test in infants with suspected monogenic disorders. Genet Med 2016;18(11):1090–1096.
Vissers et al. A de novo paradigm for mental retardation.
Nat Genet 2010;42(12):1109–1112.
Wright et al. Genetic diagnosis of developmental disorders in the DDD study: a scalable analysis of genome-wide research
data. Lancet. 2015;385(9975):1305–1314.
Yang et al. Molecular findings among patients referred for clinical whole-exome sequencing.
JAMA. 2014;312(18):1870–1879.
